Glucagon-like Peptide-1 (GLP-1)
Das Intestinalhormon GLP-1 ist ein potentes Inkretin, d.h., es verstärkt die Glucose-induzierte Insulinsekretion; ferner hemmt GLP-1 die Magenentleerung und es trägt zur Steuerung der Nahrungsaufnahme bei. Endogenes intestinales GLP-1 gilt als Sättigungshormon, weil (1) die Anwesenheit von Nährstoffen im Dünndarm die Freisetzung von GLP-1 stimuliert, (2) die parenterale Applikation von exogenem GLP-1 bei Tier und Mensch die Nahrungsaufnahme (insbesondere die Mahlzeitgrösse) reduziert und (3) die Applikation des GLP-1-Rezeptor-Antagonisten Exendin-9 (Ex-9) die Nahrungsaufnahme zumindest unter bestimmten Bedingungen stimuliert.
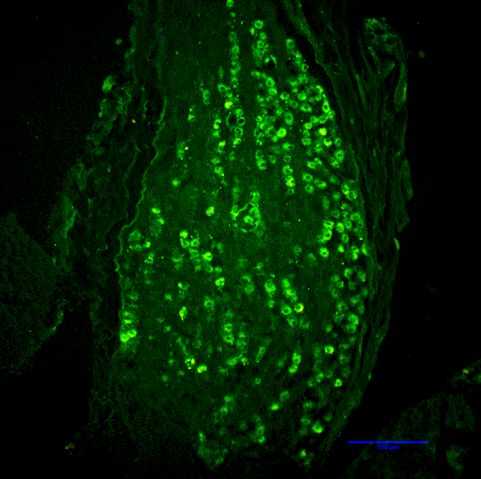
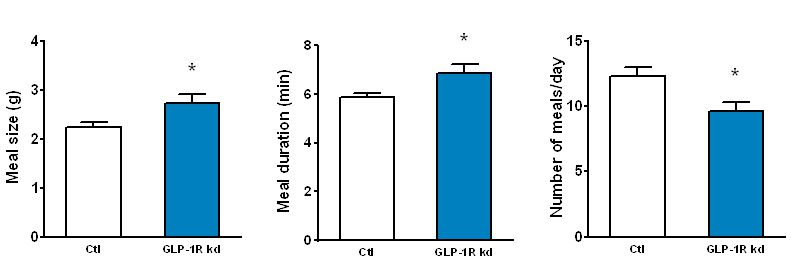
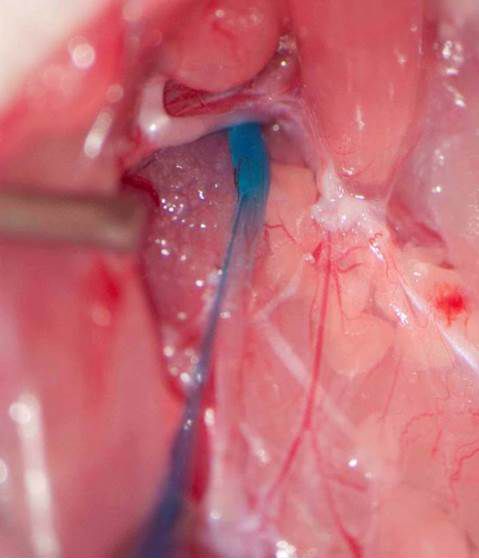
Der rasche Abbau von GLP-1 durch das Enzym Dipeptidyl Peptidase-IV (DPP-IV) limitiert das Potenzial von GLP-1 als endokrines Sättigungssignal. Unsere neueren Studien zeigen jedoch, dass endogenes intestinales GLP-1 die Nahrungsaufnahme vor allem über einen parakrinen Effekt auf vagale Afferenzen hemmt, die in der Darmwand enden. Wir wenden derzeit unterschiedliche Techniken an, um diese Hypothese kritisch zu untersuchen. Eine der neuen und von uns erstmals in-vivo eingesetzten Techniken ist das Herunteregulieren der Bildung von GLP-1-Rezeptoren in vagalen Afferenzen durch die Beeinflussung der Transkription. Erreicht wird dies durch bilaterale Mikroinjektionen eines lentiviralen Vektors mit shRNA in die Ganglia Nodosa, welche die Zellkörper der vagalen Afferenzen enthalten (Abbildungen 1 und 2). Das Herunterregulieren der GLP-1-Rezeptoren in den vagalen Afferenzen führt zu einer persistierenden Zunahme von Mahlzeitgrösse und -dauer (Abbildung 3). Interessanterweise verbessert GLP-1 auch die Kontrolle des Blutglucosespiegels partiell über diesen Mechanismus.
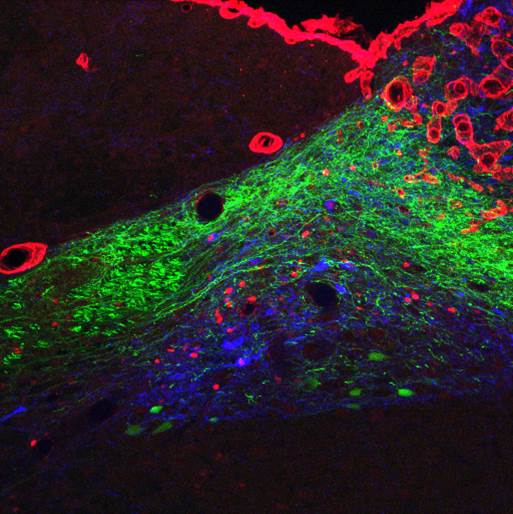
In weiteren Studien versuchen wir die Hirnareale zu kartieren, welche durch peripheres GLP-1 aktiviert werden, und die neurochemischen Mechanismen zu identifizieren, welche die Effekte von GLP-1 vermitteln (Abbildung 4). In diesem Zusammenhang interessieren wir uns auch für die Interaktionen zwischen dem peripheren und zentralen GLP-1-System. Alle diese Fragen sind wichtig für die Entwicklung noch wirksamerer GLP-1-basierender Pharmakotherapien von Adipositas und Typ-II-Diabetes sowie für die Aufklärung der möglichen Rolle von GLP-1 bei den positiven Effekten der bariatrischen Chirurgie.