Kommunikation zwischen Verdauungstrakt und Gehirn
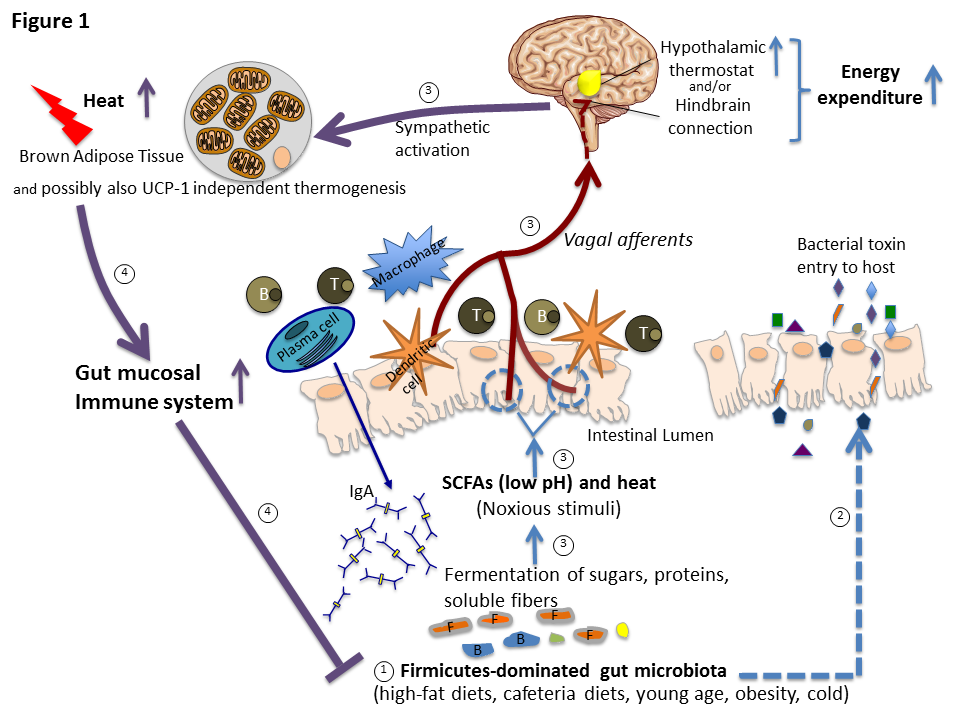
Diät-induzierte Thermogenese (DIT), d.h., der Anstieg der Energieabgabe, der über das Mass der obligaten Steigerung der Energieabgabe durch Verdauung und Verstoffwechselung der aufgenommenen Nährstoffe hinausgeht, wird oft für einen kompensatorischen Mechanismus gehalten, der dem obesogenen Effekt einer überhöhten Energieaufnahme entgegenwirkt. Für diese Annahme gibt es jedoch keinerlei experimentellen Beweis. Basierend auf mehreren Studien schlugen wir kürzlich eine andere Erklärung der DIT vor, nämlich, dass sie auf der Coevolution von Wirt und intestinalen Mikroben (insbesondere der Mikroben vom Stamm der Firmicutes) basiert. Die Annahme ist, dass diese Mikroben die Nahrungsbestandteile fermentieren und dadurch proliferieren, womit sie periodische, durch den Vagusnerv vermittelte Anstiege der Thermogenese auslösen, die letztlich die Proliferation der Mikroben im Darm limitieren (Abbildung 1, Liao et al., Cell Metabol 23, 971-979, 2016). Wegen der evolutionären Bedutung dieser Adaptation für das Immunsystem stellt die DIT keinen effizienten Verteidigungsmechanismus für eine bestimmte Körpermasse dar. Der Anstieg der Firmicutes-Population kann durch TRPV-1 Rezeptoren auf vagalen Afferenzen registriert werden. Diese werden durch den Anstieg der Temperatur und den Abfall des pH-Wertes aktiviert, welche aus der metabolischen Aktivität der Firmicutes-Bakterien resultieren. Obwohl diese TRPV-1 Rezeptoren auf vagalen Afferenzen aus Sicht der Evolution so wichtig erscheinen, um eine bakterielle Invasion des Organismus zu verhindern und damit die Gesundheit des Wirts zu erhalten, wurde ihre Rolle bei der DIT und bezüglich einer Verbesserung der intestinalen Immunität noch nie kritisch untersucht. Wir planen, dies unter Einsatz unserer ausgeklügelten Techniken zur Untersuchung der Kommunikation zwischen Verdauungstrakt und Gehirn zu tun.
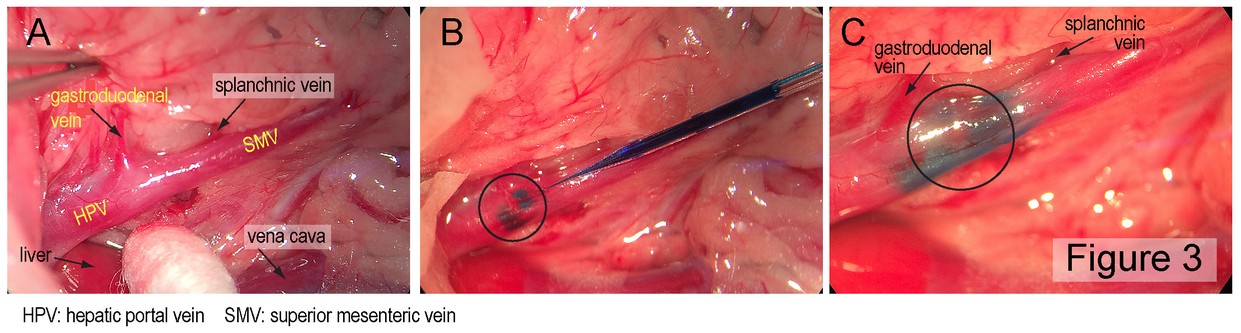
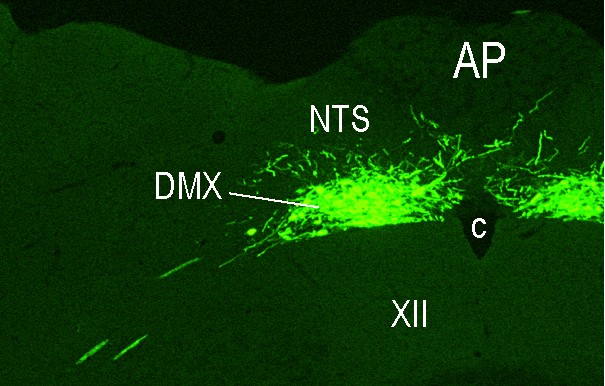
“Metabolic sensing” im Verdauungstrakt: Ein komplexes System, welches die chemosensorischen Eigenschaften der Nahrung sowie ihre Menge und Zusammensetzung registriert, stellt sicher, dass der Organismus optimal auf die Verdauung, Resorption und Verstoffwechslung der aufgenommenen Nährstoffe vorbereitet ist. Die verschiedenen Komponenten dieses Systems und wie sie untereinander sowie mit dem Gehirn interagieren sind weitgehend unbekannt. Um diese Fragen umfassend zu untersuchen, arbeiten wir mit Professor Alan Watts (University of Southern California, Los Angeles, CA) und Professor Alan Spector (Florida State University, Tallahassee, FL) zusammen um 1) die Hirnareale zu identifizieren, wo die nährstoffbezogene sensorische Information von Mundhöhle, Darm und hepatischer Pfortader verarbeitet wird, 2) zu analysieren, wie dies geschieht und 3) aufzuklären wie das Gehrin die adäquaten endokrinen und metabolischen Antworten generiert. Alle drei anatomischen Lokalisationen (Mundhöhle, Dünndarm und Pfortader) beherbergen sensorische Elemente, welche nährstoffbezogene und metabolische oder endokrine Signale in Nervenimpulse umwandeln und auf unterschiedlichen Wegen (im Wesentlichen Geschmacksnerven, Vagusnerv sowie sympathische Afferenzen) an den Hirnstamm übermitteln. Dort aktivieren sie weit verzweigte Netzwerke, welche das Essverhalten steuern sowie die metabolische Homöostase erhalten. Die exakten Hirnareale, welche diese sensorische Information vom Verdauungstrakt empfangen, sowie wie und wo sich die über die einzelnen Nerven vermittelte Information aufteilt, ist weitgehend unbekannt. In diesem Zusammenhang untersuchen wir die Organisation der betreffenden Netzwerke, indem wir die Informationswege von der Mundhöhle, vom Dünndarm und von der Pfortader zum Gehirn mit dem antergograd transportierten Herpes simplex Virus H129 (HSV-H129) verfolgen. Vorversuche zu diesen Studien mit Injektionen des HSV-H129 in die Wand der Pfortader haben bereits stattgefunden, anlässlich eines Forschungsaufenthalts von Alan Watts in unserem Labor im vergangenen Jahr (siehe Abbildungen 2 und 3). In weiteren Experimenten werden wir selektive Denervationstechniken einsetzen, um zu erreichen, dass das HSV-H129 nach Injektion in die Darmwand entweder über vagale oder spinale Afferenzen transportiert wird. Um zu klären, wie die afferente sensorische Information mit den zugehörigen efferenten Bahnen verbunden ist, welche beispielsweise die Freisetzung von Insulin aus dem endokrinen Pankreas steuern, wird ein retrograd transportiertes, neurotropes Pseudorabies-Virus eingesetzt, welches in das Pankreas injiziert wird – zusätzlich zu den HSV-H129 Injektionenn in die Geschmackspapillen, die Dünndarmwand und die Wand der Pfortader. Zusätzlich werden die endokrinen und metabolischen Effekte der Verabreichung bestimmter Metabolite in die Mundhöhle, den Dünndarm oder die Pfortader erfasst, um die funktionelle Bedeutung der durch das viral tracing identifizierten Nervenverbindungen zu bestimmen.
